ESTRUCTURA DE LA MATERIA
Las primeras ideas de como estaba formada la materia surgieron con los filósofos de la antigua Grecia, los cuales sin seguir las bases del método científico, establecieron dos teorías: atomista y continuista.
TEORÍA ATOMISTA
En el siglo V a.C., Leucipo pensaba que sólo había un tipo de materia. Sostenía que si dividíamos la materia en partes cada vez más pequeñas, acabaríamos encontrando una porción que no se podría seguir dividiendo. Un discípulo suyo, Demócrito, bautizó a estas partes indivisibles de materia con el nombre de átomos, término que en griego significa “que no se puede dividir”. Para el año 400 a. de C. Demócrito y Leucipo propusieron la primera teoría atómica llamada la “Discontinuidad de la Materia”.
- Los atomistas pensaban que:
- Todo está hecho de átomos. Si dividimos una sustancia muchas veces, llegaremos a ellos.
- Las propiedades de la materia varían según como se agrupen los átomos.
- Los átomos no pueden verse porque son muy pequeños.
- Los átomos son eternos.
- Las propiedades de la materia varían según el agrupamiento de los átomos.
TEORÍA CONTINUISTA
Aproximadamente del año 400 antes de Cristo hasta finales de 1500, el átomo fue olvidado. Aristóteles había creído que toda la materia estaba hecha de cuatro elementos: fuego, agua, tierra y aire, esta teoría se llamó continuista. Como Aristóteles era un sabio, la gente aceptaba la teoría de los cuatro elementos y el avance del estudio de la materia quedó estancado durante varios siglos.
Los continuistas pensaban que:
- Los átomos no existen.
- No hay límite para dividir la materia.
- Si las partículas, llamadas átomos, no pueden verse, entonces es que no existen.
- Todas las sustancias están formadas por las combinaciones de los 4 elementos básicos: agua, aire, tierra y fuego.
TEORÍAS CON BASE CIENTÍFICA
Teoría Atómica de John Dalton
 En el siglo V A.C el filosofo griego Demócrito expresó la idea de que toda la materia estaba formada por muchas partículas pequeñas e indivisibles que llamó átomos (que significa indestructible o indivisible). A pesar de que la idea de Demócrito no fue aceptada por muchos de sus contemporáneos (entre ellos. Platón y Aristóteles), ésta se mantuvo. Las evidencias experimentales de algunas investigaciones científicas apoyaron el concepto del “atomismo”, lo que condujo, de manera gradual, a las definiciones modernas de elementos y compuestos. En 1808, un científico inglés, el profesor John Dalton, formulo una definición precisa de las unidades indivisibles con las que está formada la materia y que llamamos átomos.
En el siglo V A.C el filosofo griego Demócrito expresó la idea de que toda la materia estaba formada por muchas partículas pequeñas e indivisibles que llamó átomos (que significa indestructible o indivisible). A pesar de que la idea de Demócrito no fue aceptada por muchos de sus contemporáneos (entre ellos. Platón y Aristóteles), ésta se mantuvo. Las evidencias experimentales de algunas investigaciones científicas apoyaron el concepto del “atomismo”, lo que condujo, de manera gradual, a las definiciones modernas de elementos y compuestos. En 1808, un científico inglés, el profesor John Dalton, formulo una definición precisa de las unidades indivisibles con las que está formada la materia y que llamamos átomos.El trabajo de Dalton marcó el principio de la era de la química moderna. Las hipótesis sobre la naturaleza de la materia, en las que se basa la teoría atómica de Dalton, pueden resumirse como sigue:
- Los elementos están formados por partículas extremadamente pequeñas llamadas átomos. Todos los átomos de un mismo elemento son idénticos, tienen igual tamaño, masa y propiedades químicas. Los átomos de un elemento son diferentes a los átomos de todos los demás elementos.
- Los compuestos están formados por átomos de más de un elemento. En cualquier compuesto, la relación del número de átomos entre dos de los elementos presentes siempre es un número entero o una fracción sencilla.
- Una reacción química implica sólo la separación, combinación o reordenamiento de los átomos, nunca supone la creación o destrucción de los mismos.
Modelo Atómico de Thomson
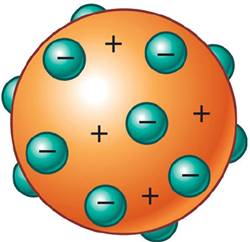
Teoría Atómica de Rutherford
Para Ernest Rutherford, el átomo era un sistema planetario de electrones girando alrededor de un núcleo atómico pesado y con carga eléctrica positiva.El módelo atómico de Rutherford puede resumirse de la siguiente manera:
Rutherford no solo dio una idea de cómo estaba organizado un átomo, sino que también calculó cuidadosamente su tamaño (un diámetro del orden de 10-10 m) y el de su núcleo (un diámetro del orden de 10-14m). El hecho de que el núcleo tenga un diámetro unas diez mil veces menor que el átomo supone una gran cantidad de espacio vacío en la organización atómica de la materia.
Para analizar cual era la estructura del átomo, Rutherford diseñó un experimento:
MODELO ATÓMICO DE BOHR
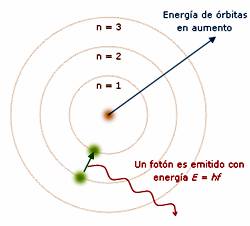
La nueva concepción de la luz y la energía, motivó al físico danés Niels Bohr, a dar una explicación al hecho que constituyó el espectro de emisión de los gases, basándose concretamente en el átomo de hidrógeno, dio lugar en 1913, a un nuevo modelo atómico, llamado modelo atómico de Bohr o también conocido como de Bohr-Rutherford, el cual puede ser considerado el precedente del modelo atómico actual. Se trata de un modelo más que nada funcional, ya que no habla del átomo en sí, sino que da explicación a su funcionamiento mediante ecuaciones.
El electrón se mueve entorno al núcleo formando órbitas circulares. El espacio que está entorno al núcleo se dice que está cuantizado, lo que significa que, hay partes, o zonas permitidas, conocidas como niveles, y otras que no. Si un electrón no cambia de órbita, no cambia tampoco su energía.
Las orbitas permitidas son en las que, el momento angular del electrón ( mvr), es múltiplo de h/2π de donde h es la constante de Planck. m v r = n. h/ 2π , de donde n es el número cuántico principal, y determina los niveles entorno al núcleo, numerados a partir del núcleo, n= 1,2,3,… , lo que significa que la energía y los radios de las órbitas están cuantizados. Cuando un átomo emite o absorbe energía, lo realiza mediante cuantos completos de valor h.ν , y esto es debido a que el electrón experimenta un tránsito entre niveles, que se puede resumir en :
E2 – E1 = hν
de donde, E1= energía del nivel inicial y E2 = energía del nivel final.
-El átomo absorbe energía si E2 > E1
-El átomo emite energía si E2 < E1
MODELO ATÓMICO DE SOMMERFELD
El físico alemán Arnold Sommerfeld, crea en 1916, el modelo atómico que lleva su nombre, para dar algunas mejoras al modelo atómico de Bohr, ayudándose de la relatividad de Albert Einstein, teoría que había conocido al entrar como profesor en la Universidad de Munich, cuando aun la teoría de la relatividad no estaba aceptada. Sommerfeld, es más conocido en el mundo científico por su aportación a la ciencia con la constante de la estructura fina en 1919, que es la constante física fundamental en la interacción electromagnética.
Así, las órbitas con:
- l=0 serían los posteriormente conocidos como orbitales S.
- l=1 se llamaría orbital 2p u orbital principal.
- l=2 se conocería como d, u orbital diffuse.
- L=3 sería el orbital llamado f o fundamental.
Modelo atómico de Schrödinger

El modelo atómico de Schrödinger no se trata de un modelo relativista, sino cuántico, que está basado en la ecuación que este físico austríaco realizó en 1925.
Representa los orbitales presentes en un subnivel.
Erwin Schodinger propuso el modelo atómico actual, también conocido como: "Ecuación de Onda"
Planteó la idea de que el electrón podría considerars ecomo una onda pra explicar su comportamiento en el átomo. La ecuación de Onda consiste en una fórmula matemática que corresponde a la medida de la probabilidad de encontrar un electrón en un cierto espacio.
En esta teoría se consideran los siguientes aspectos: dualidad de la materia caracter onda-partícula, estados estacionarios o niveles de energía fundamentales, la presencia de un núcleo atómico con presencia de partículas subatómicas, probabilidad en cuanto a la posición, movimiento y energía de los electrones.
La función de onda para un electrón dependerá de los valores de los Números Cuánticos.
Planteó la idea de que el electrón podría considerars ecomo una onda pra explicar su comportamiento en el átomo. La ecuación de Onda consiste en una fórmula matemática que corresponde a la medida de la probabilidad de encontrar un electrón en un cierto espacio.
En esta teoría se consideran los siguientes aspectos: dualidad de la materia caracter onda-partícula, estados estacionarios o niveles de energía fundamentales, la presencia de un núcleo atómico con presencia de partículas subatómicas, probabilidad en cuanto a la posición, movimiento y energía de los electrones.
La función de onda para un electrón dependerá de los valores de los Números Cuánticos.
NUMEROS CUANTICOS
1) NÚMERO CUÁNTICO PRINCIPAL (n)
Representa los niveles energéticos. Se designa con números enteros positivos desde n=1 hasta n=7 para los elementos conocidos.
2) NÚMERO CUÁNTICO SECUNDARIO O AZIMUTAL ( l )
Determina el subnivel y se relaciona con la forma del orbital.
Cada nivel energético ( n ) tiene "n" subniveles.}
Cada nivel energético ( n ) tiene "n" subniveles.}
3) NÚMERO CUÁNTICO MAGNÉTICO (m)
Representa los orbitales presentes en un subnivel.
Se designa con números que van de -l a + l pasando por cero.}
4) NÚMERO CUÁNTICO POR SPIN (s)
Se relaciona con el giro del electrón sobre su propio eje. Al estar juntos en un mismo orbital, un electrón gira hacia la derecha y otro hacia la izquierda. Se le asignan números fraccionarios: -1/2 y +1/2
No hay comentarios:
Publicar un comentario